作者/講者: 林聰蓉 醫師
整理: 黃昌弘 醫師
校稿: Ian YC Chen, MD
上次校閱: 2018/06/07

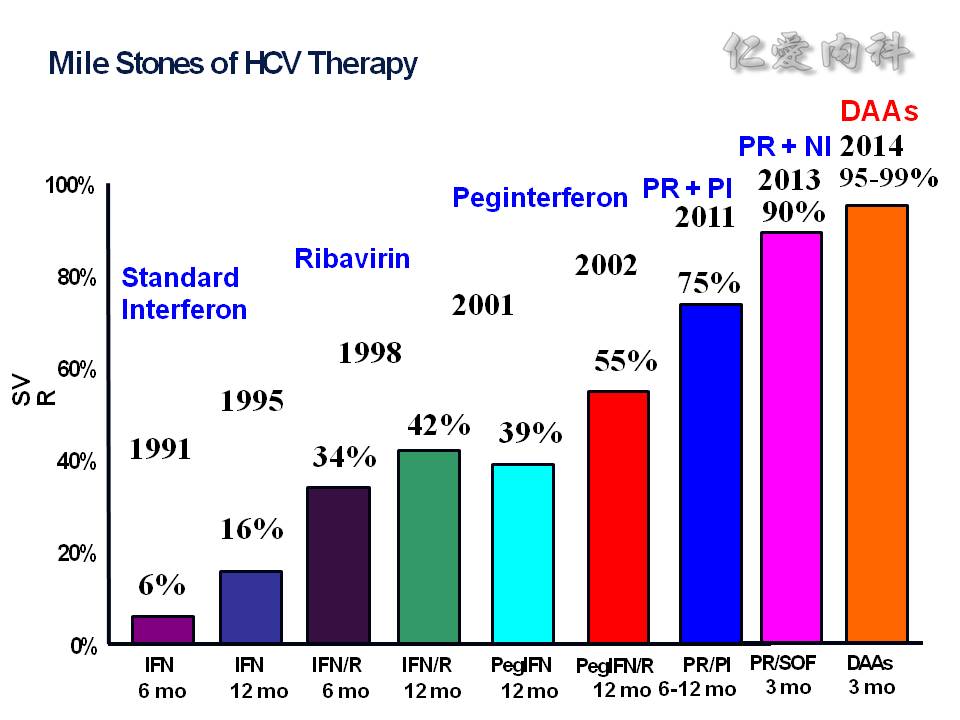
在新的藥物 DAA (Direct –acting antivirals) 進展下, 2014 年的 SVR (sustain virological response;完治後 24 周,抽血測不到病毒量) 可以達到 95-99%

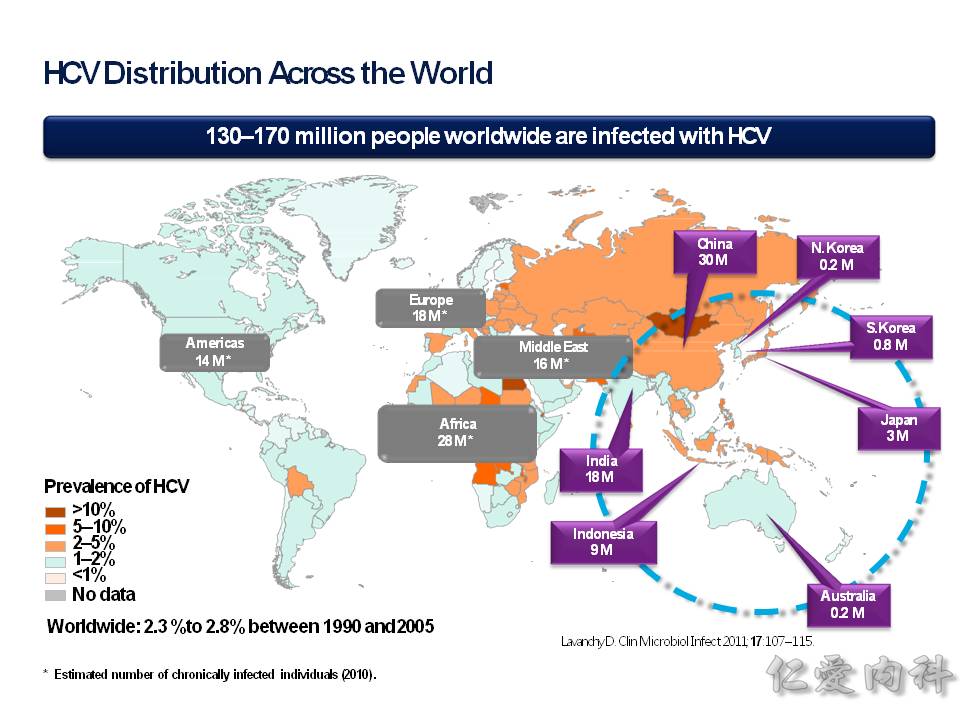
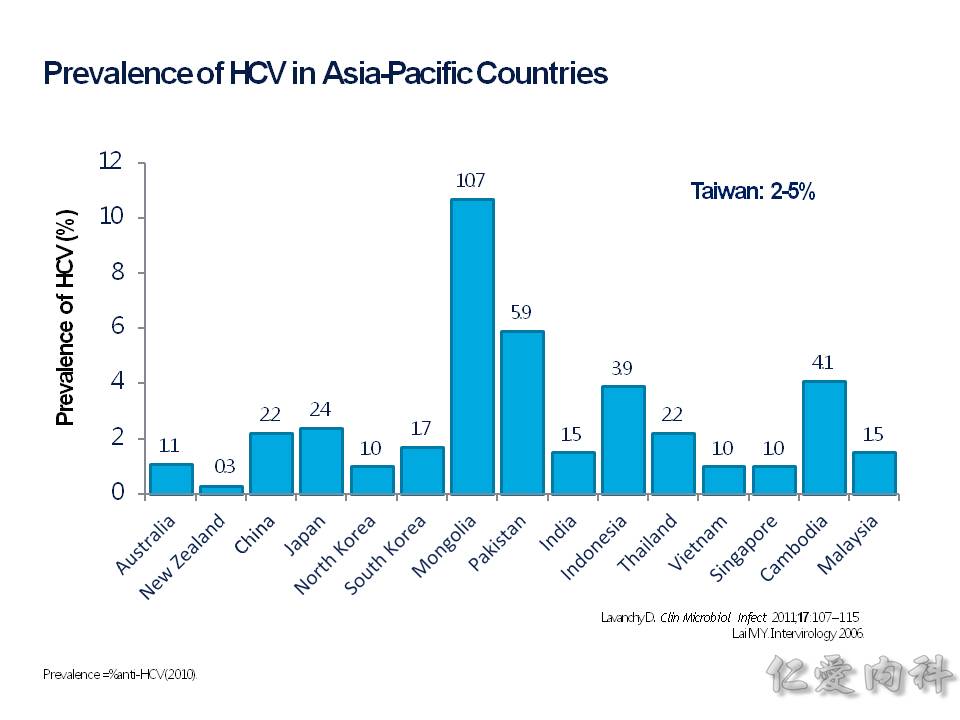
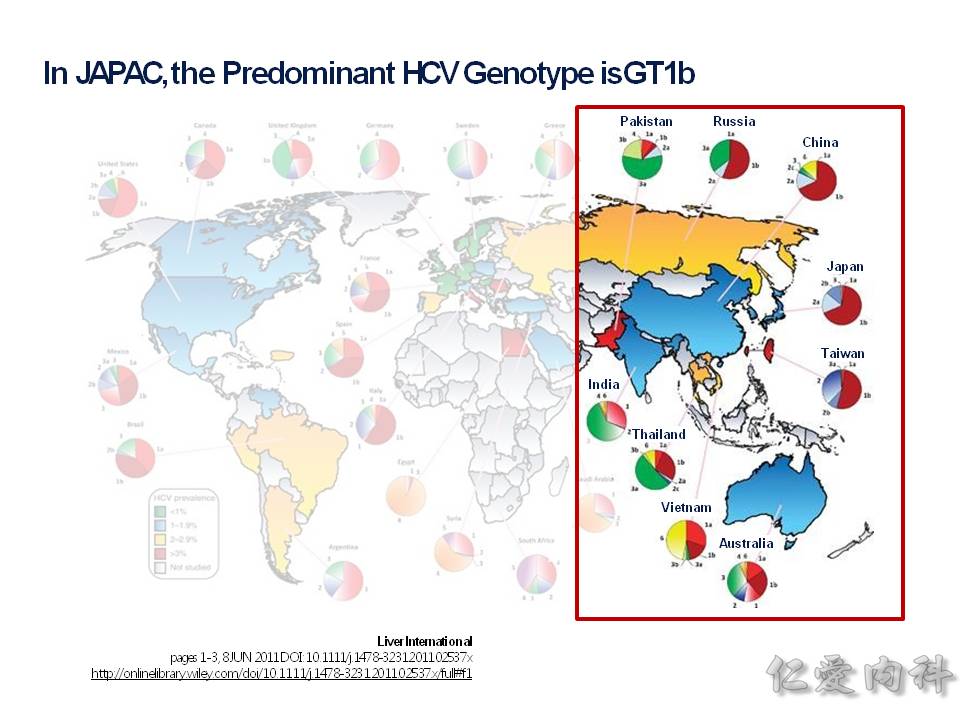
流行病學的部分,台灣在圖中顯示是 2-5% 的 prevalance (盛行率),相對於周圍的亞洲國家來說算是高的!

台灣 1992 年以前多因為輸血而感染。然後我們從 1992 年開始做全面的 HCV 篩檢,所以大幅減少了因為輸血而感染 HCV。
1992 年後常見的感染族群是 (1) 共用針頭,施打藥物、毒品 (2) 同性戀族群 產生的感染。 # 母傳子的感染只佔了 2-8%.

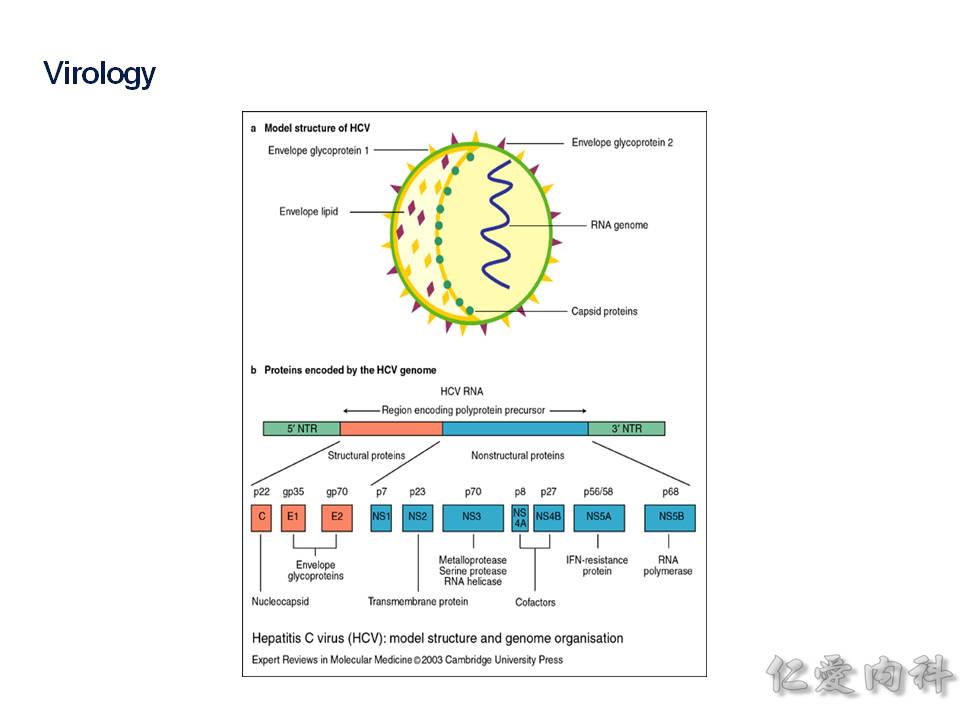
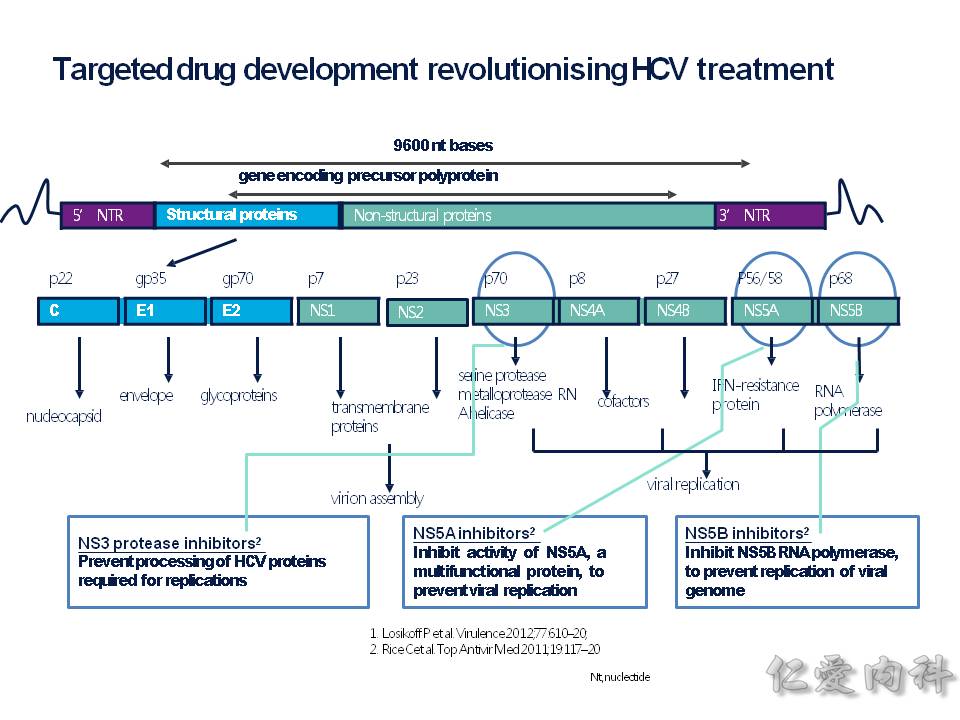
HCV 是 RNA 病毒,基因轉錄出來的蛋白質可以分成 (1) 結構性的蛋白質 (藍色), (2) 非結構性蛋白質 (綠色)。而我們的 C 肝用藥是在抑制: N53、NS5A、NS5B 這三個目標物 (這算是 DAA: Direct – acting antivirals)。

目前的C肝基因型 (genotype) 有6種 (1a, 1b, 2a, 2b, 3, 4, 5, 6),又可以分成 10 多種亞型,定義上只要 > 34% 的基因不一樣就視為不同的 genotype;因為 C 肝病毒是 RNA 病毒,沒有像是 DNA 病毒複製的時候的偵錯、效正機制,所以基因的變異性非常大。
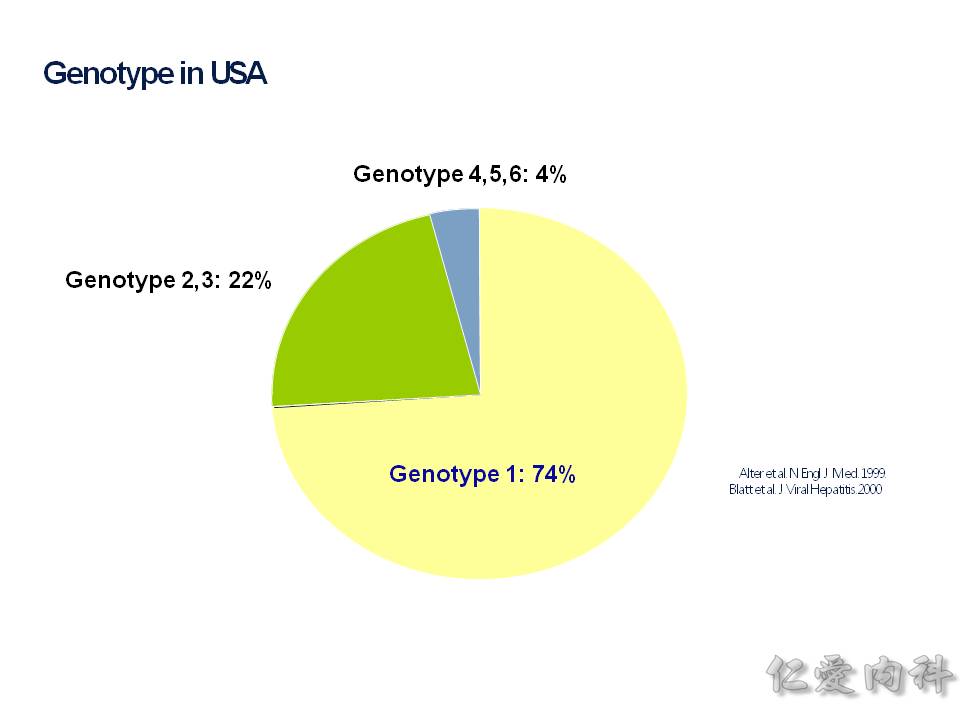
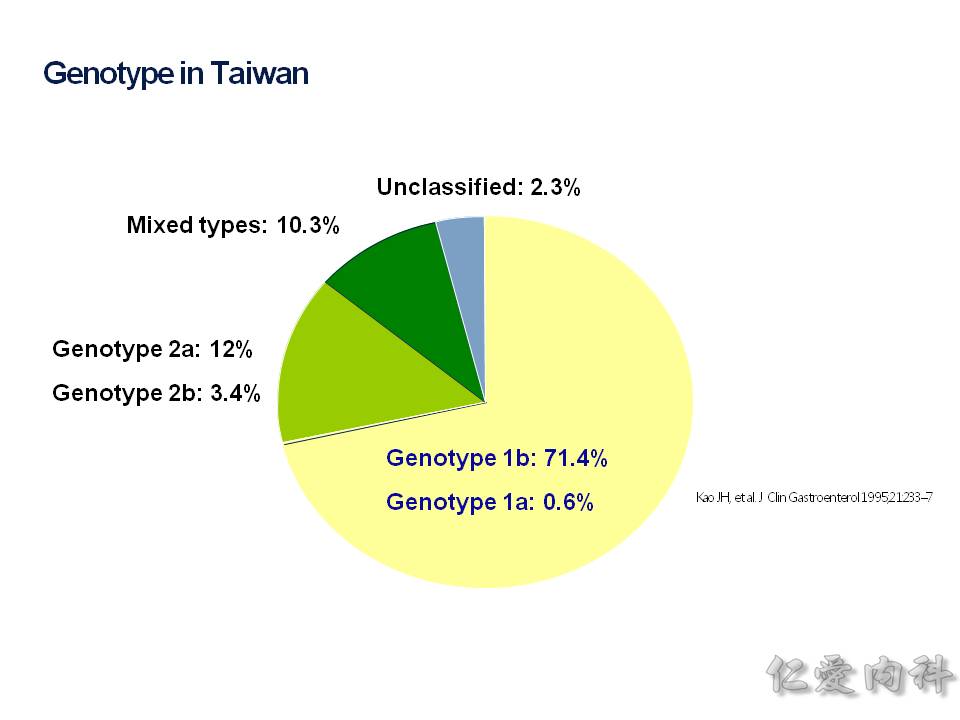
台灣現況以基因型 genotype: 1b 為主,占了 71.4%,基本上基因型 1b 算是好治療的類型,第二名的是 2a。


C 肝的診斷的部分,一般來說從接觸到 C 肝病毒的那一刻起,大約 2 週左右抽血驗 HCV RNA 可以驗到陽性,大約 6 周左右抽血驗 anti-HCV 抗體可以驗到陽性,所以被針扎的人可以在針扎的時間算起 6 週左右去驗 anti-HCV 抗體,不過 anti-HCV 抗體並不是代表人們有免疫力的抗體,只是代表有C肝帶原。
(#反之,B 肝的 anti-HBs 抗體,代表此人有針對 B 型肝炎的免疫力)
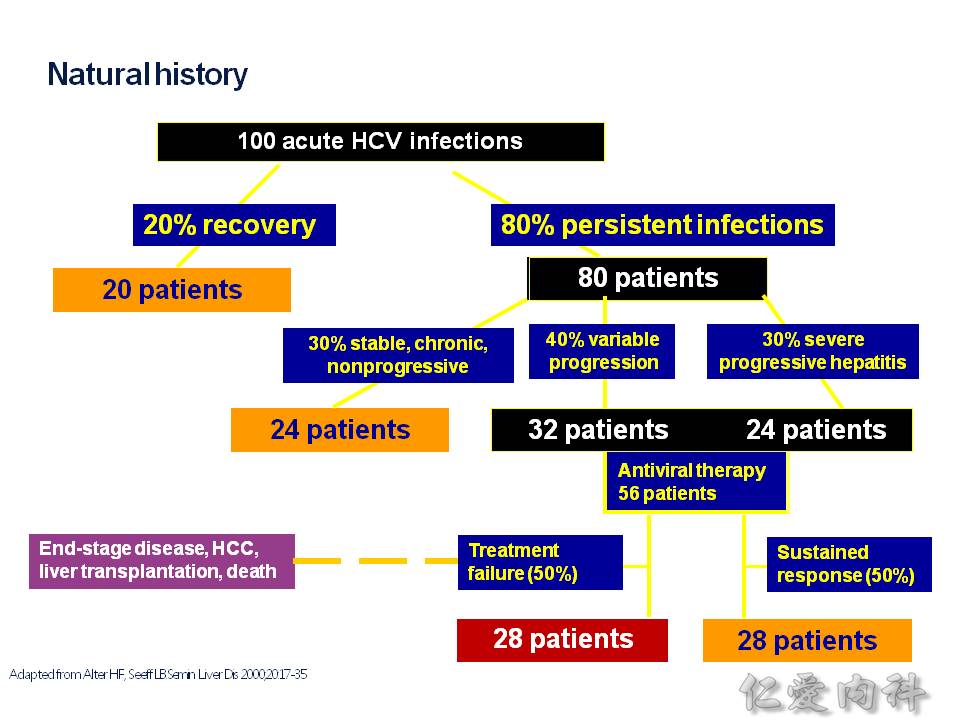
C 肝感染之後,一般會發展成 4 種狀況:
- 1. 痊癒
- 2. 慢性 C 肝帶原
- 3. 一時之間還沒有發病,隨著免疫力下降或其他因素,而轉變成急性肝炎
- 4. 直接變成急性肝炎,甚至是猛爆性肝炎
# 以上說的 (3)(4) 的情況需要 C 肝的抗病毒藥物使用,不過還是有一些人因為治療失敗而走向肝硬化、肝癌進而死亡的情況。
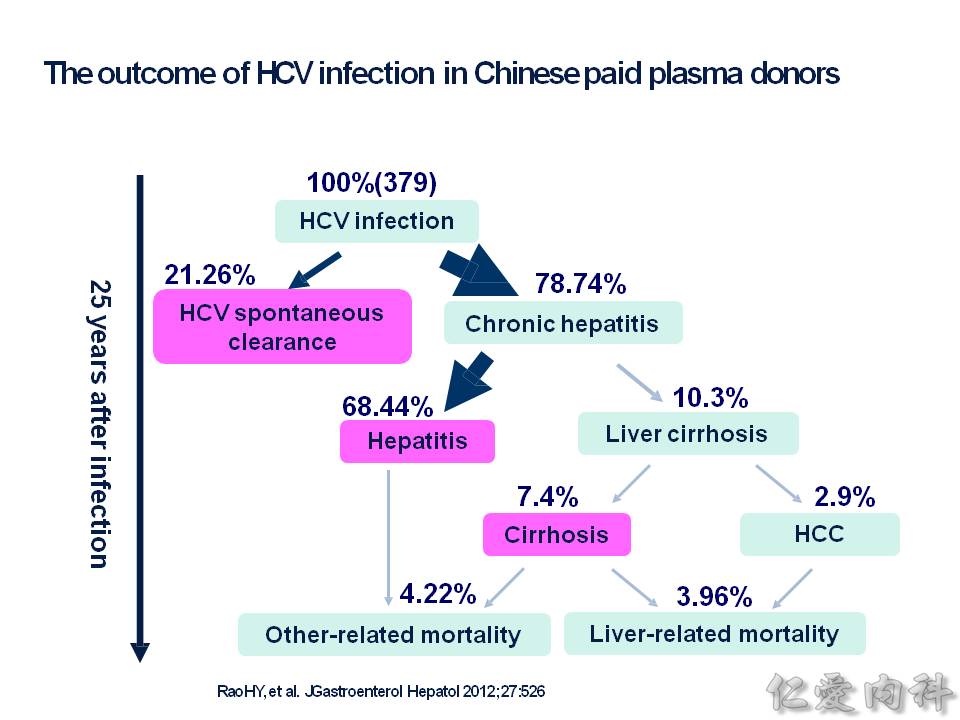
C 肝病人統計起來,最終有 10% 的病人因此進展到肝硬化,甚至是肝癌而死亡,而猛爆性肝炎造成的死亡也是有的。
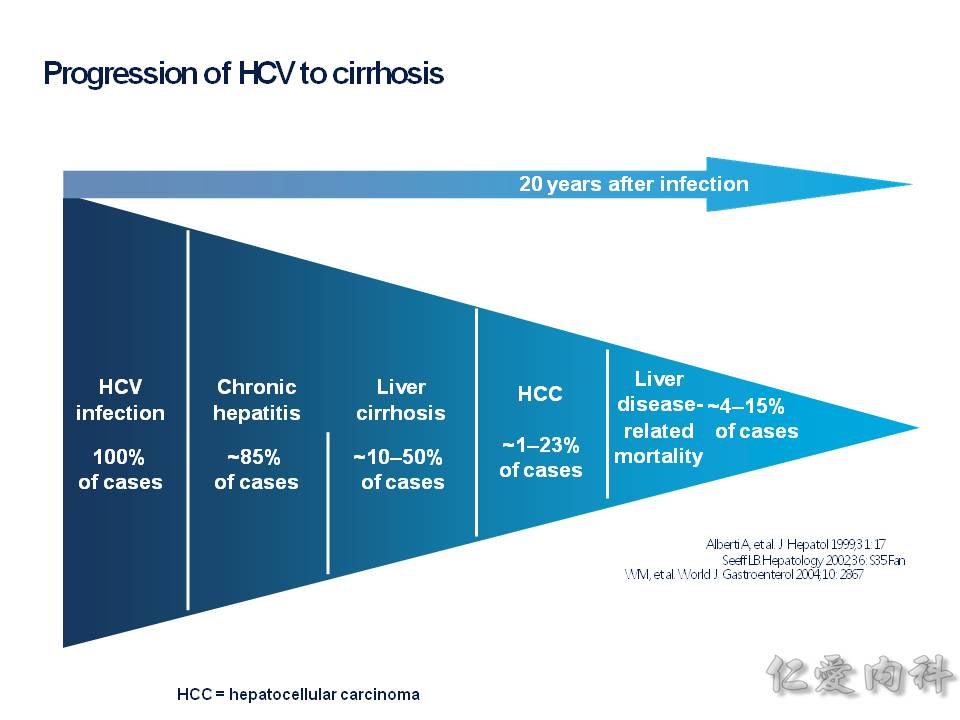
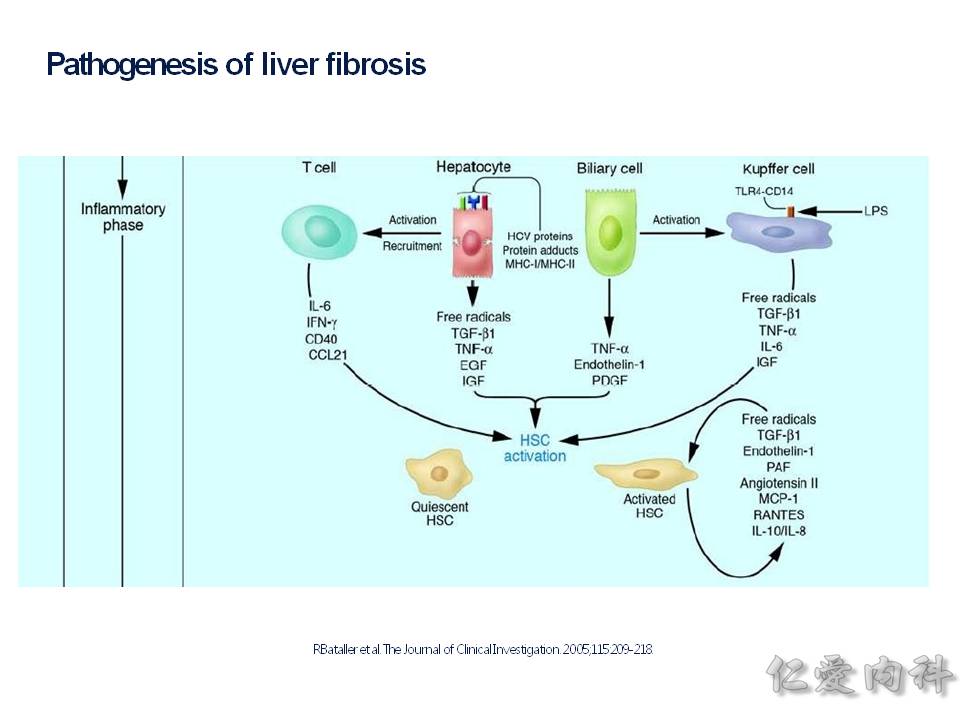
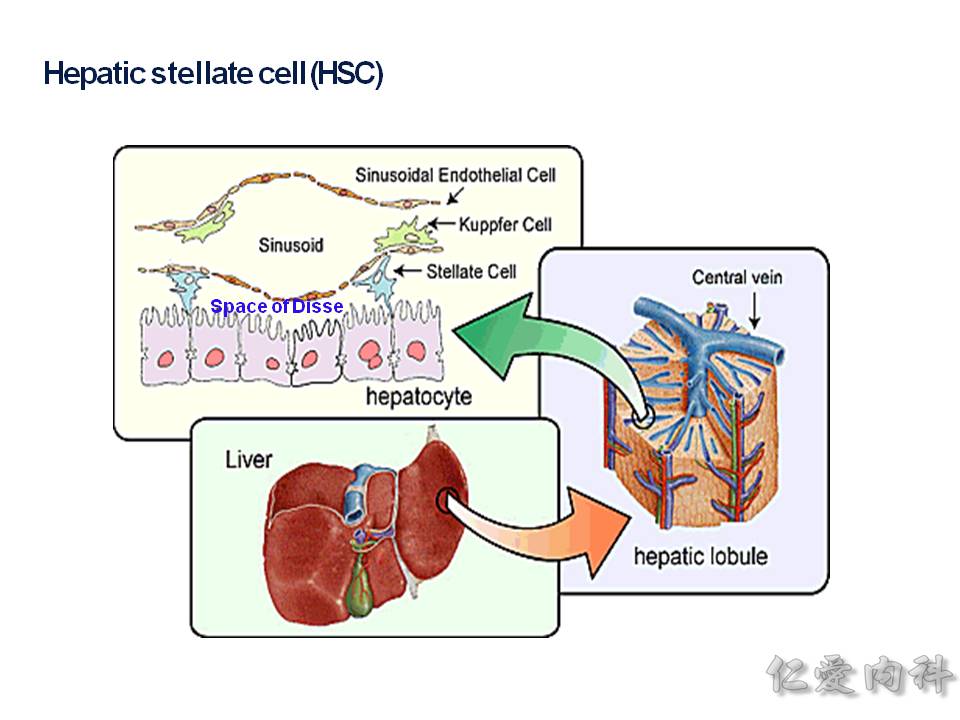
肝臟內有 HSC(hepatic stellate cell) 星狀細胞,它會被種種的機轉給活化,產生很多的 collengen fibers,若是來不及讓肝臟內的巨噬細胞 (Kuppfer cells) 給移除掉,則會造成肝臟的纖維化(fibrosis).
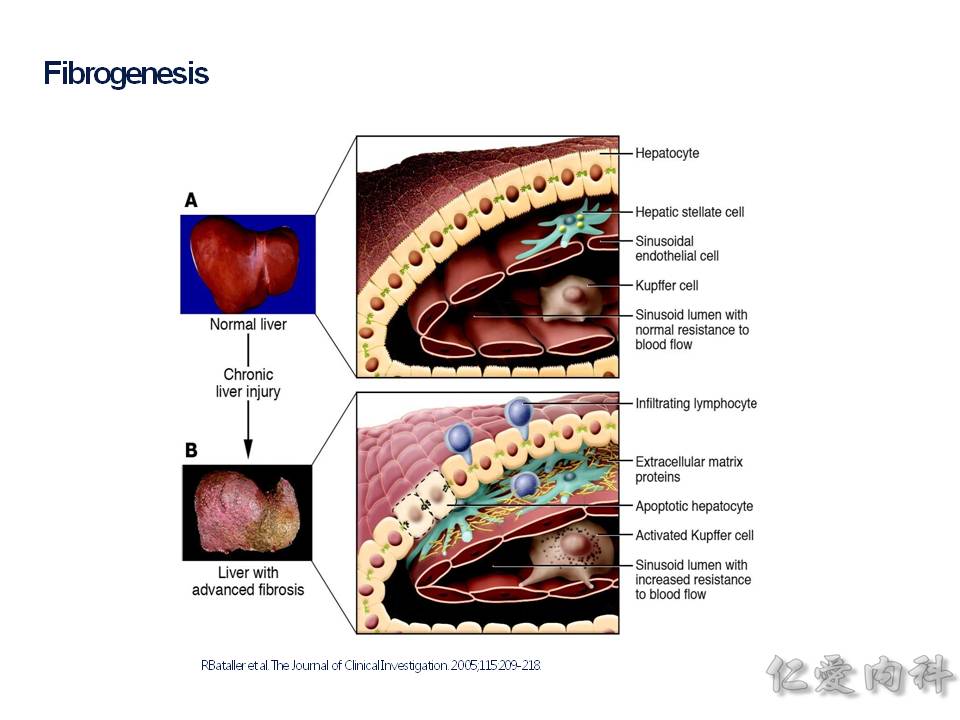
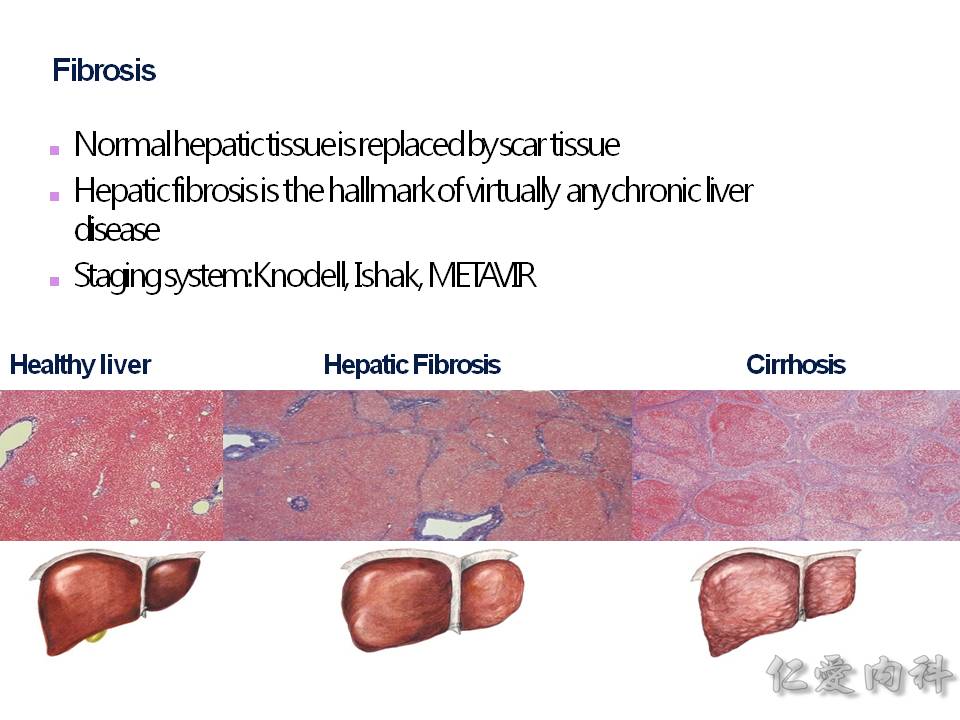


要如何評估肝臟纖維化的情況,可以靠肝切片的病理報告,依據 Metavir staging 分成 F0~F4 的分類,F0 是沒有纖維化,F4 是完全的肝硬化了。
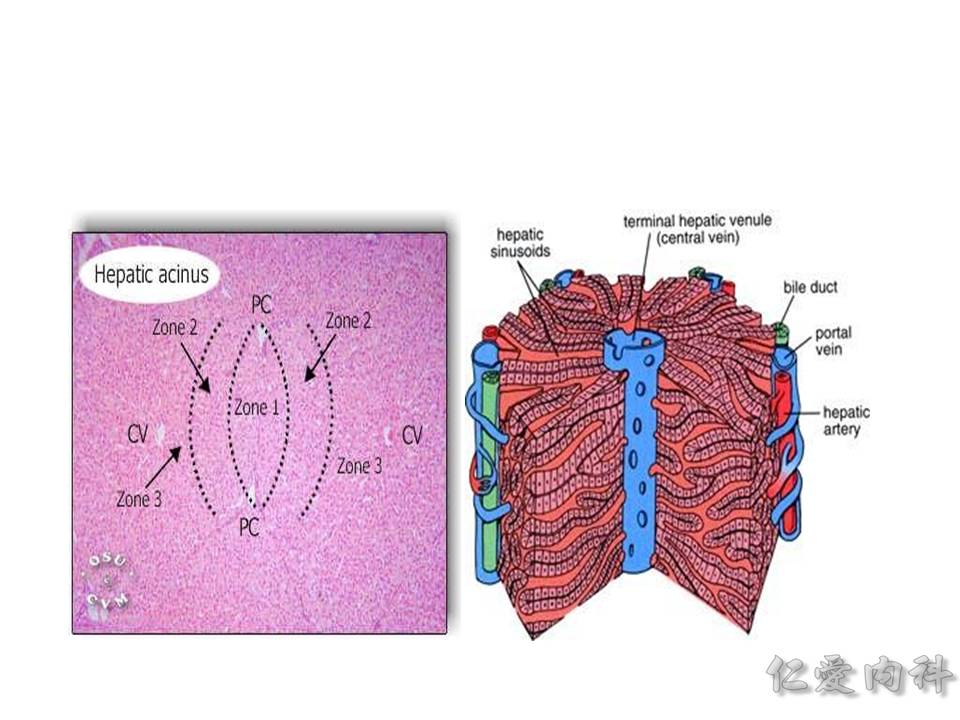
要怎麼樣分成 F0~F4 呢? 一般肝臟纖維化會先從 portal vein (肝門靜脈) 開始,慢慢纖維化到 central vein (肝靜脈) 那裡。 結構上肝臟切片在病理組織上是一個六角形的結構,正中心是 central vain (肝靜脈),周圍的六個角的頂點就是 portal vein (肝門靜脈)、肝動脈、肝內小膽管的 Triad 三者所在地。

所以 Metavir staging 會說從 P-P (portal to portal;六角形的頂點到六角形的六個邊),進展到 P-C (portal to central vein;纖維化慢慢從外往內到 central vein),最終進展到切片下的所有範圍都是纖維化,那就是肝硬化 (F4) 了!
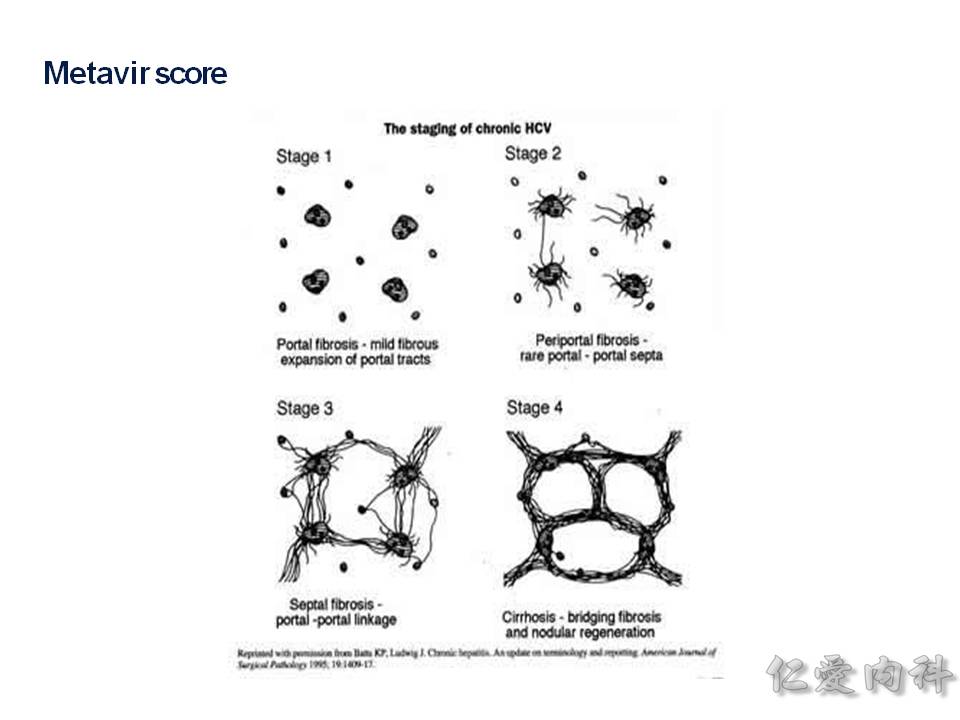
再看一下圖片就很明顯可以了解: F1、F2、F3、F4 之間的差異了!
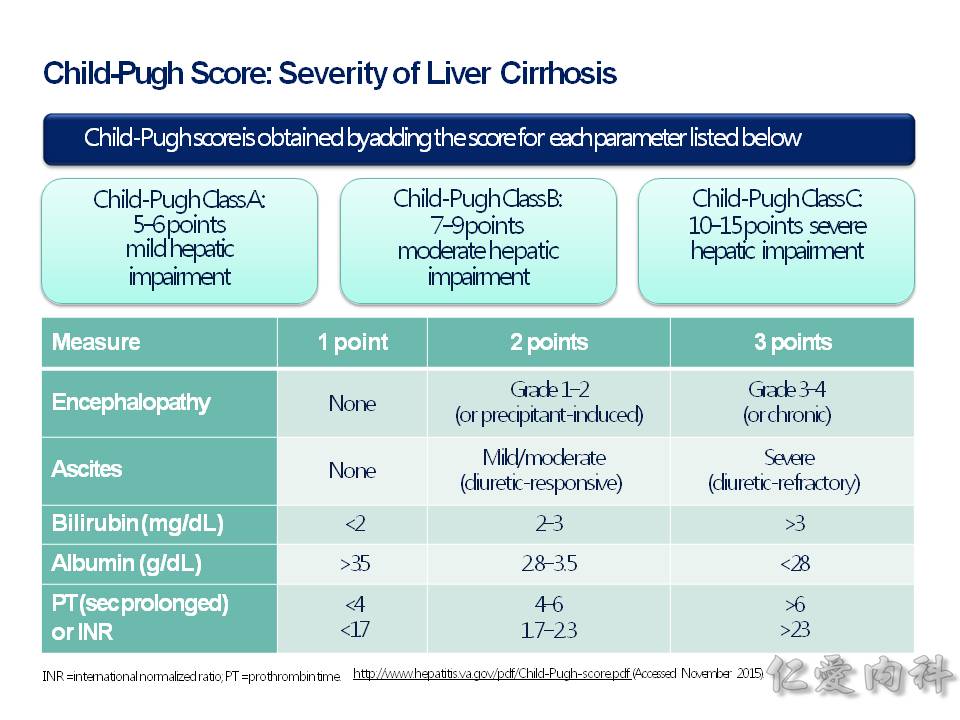


非侵入性的方法,可以定期做 FibroScan 纖維化的掃瞄,來看看有沒有肝硬化及其程度。


非侵入性方法-1: 也可以用抽血來計算 APRI,只要有 AST 及 Platelet 兩個數值,切 1.5 以上越可能有肝纖維化,0.5 以下較不可能有肝纖維化。
非侵入性方法-2: 只要有抽血驗 AST, ALT,就可以測 FIB-4 來計算,算出來的值超過 3.25 較可能有嚴重的肝纖維化,低於 1.45 較不可能有肝纖維化。
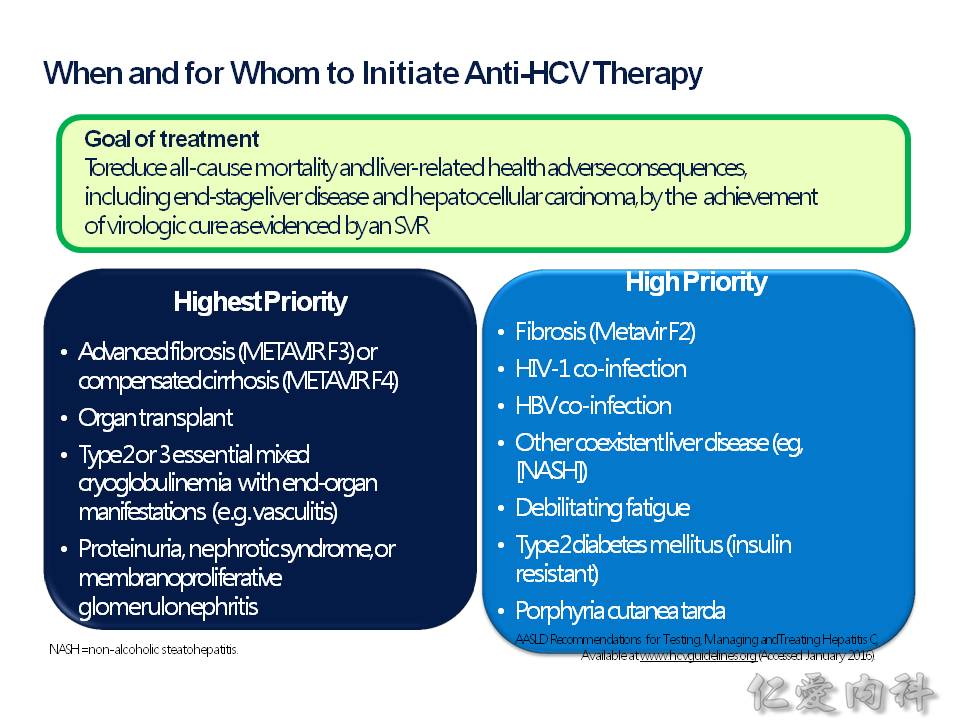
何時應該要啟動 C 肝的治療,[最高順序] 就是:
- Metavir F3 或 F4 的肝纖維化
- 肝臟移植以後 (要防止移植的肝臟又肝硬化)
- 有因為 C 肝合併了第 2、第 3 型的冷凝球蛋白血症,此疾病會造成血管炎,影響到器官功能
- 有因為 C 肝合併了膜增生性腎小球腎炎 (MPGN) 及蛋白尿,傷害到了腎功能

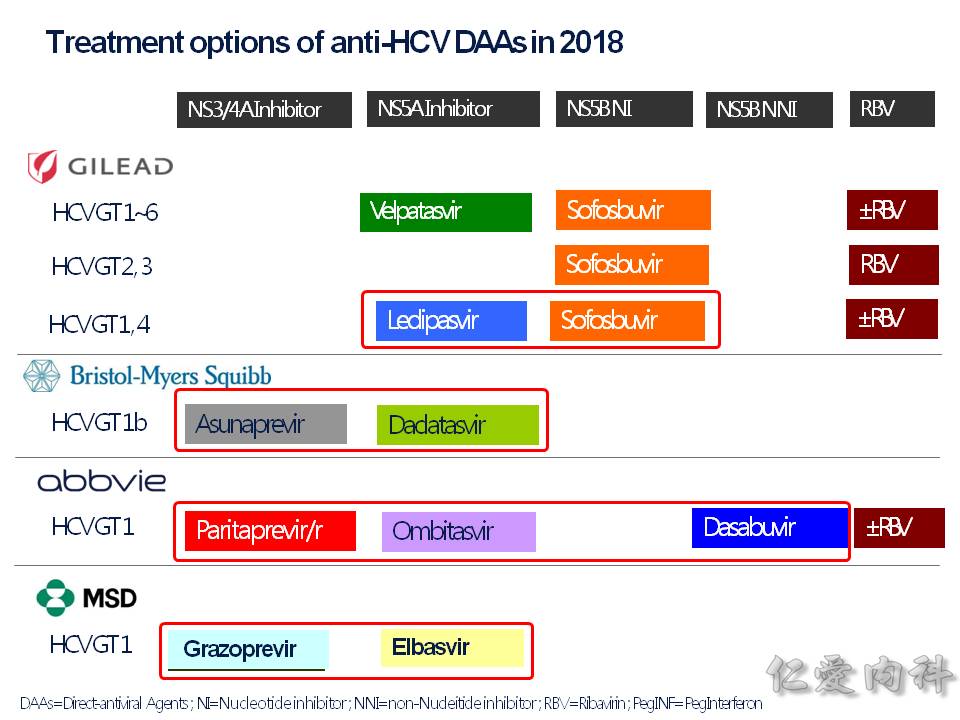
治療的部分,非常多的藥物可以使用:
- 我們熟知的藥物 Peg-interferon (干擾素)加上 Ribavirin (RBV) 合併治療是使用在 genotype 2 或 3 的部分,但是這樣的治療副作用較常見。台灣目前genotype第一名是 1b, 第二名是 2a。
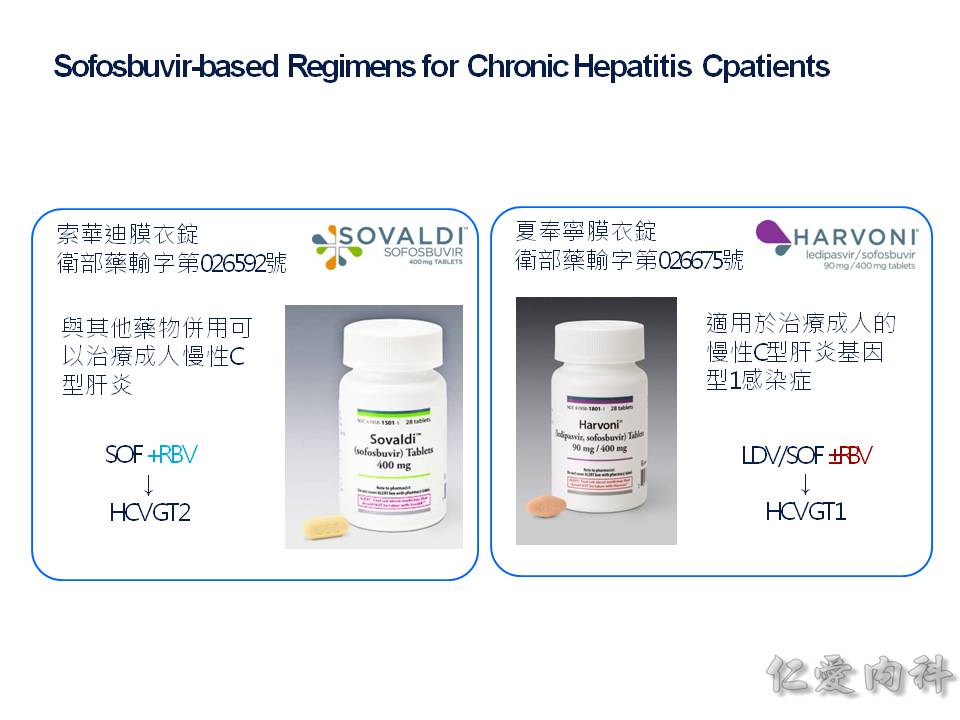
- Sofosbuvir (商品名 Solvadi) 是算是 DAA (direct-acting anti-virus) 的其中一員,直接作用在抑制 NS5B 聚合酶,它主要的禁忌是要注意 (1) 造成 HBV 的活化.(2) 合併 amiodarone 使用的心跳過慢. (3) 腎功能差 GFR<30。 它一定要合併其他藥物合用,不能單獨使用。
- Sofosbuvir 加上 Ledipasvir 的這個複方藥物: Harvoni (夏奉寧) 在 2018 年的現在,因為價位上大幅下降,目前的市佔率非常高。Ledipasvir 它抑制在 NS5B 上面,和 sofosbuvir 一樣是 DAA,等於說是兩種 DAAs 合併使用。台灣目前核准在 genotype 基因型 1b 上面,可以合併 Ribavirin 使用 12-24 周或單獨使用。研究顯示:單獨使用 Harvoni 12 周可以達到接近 100% 的 SVR: sustained viralogic response: 指治療完成後,在等 12 周抽血卻測不到 C 肝病毒。
- Daklinza (daclatasvir) + Sunvepra (asunaprevir) 也是一個複方藥物,使用於 genotype 1b, 使用 24 週。其中的成份 asunaprevir 於肝臟功能不好的病人,不建議使用,反而易使肝指數上升。
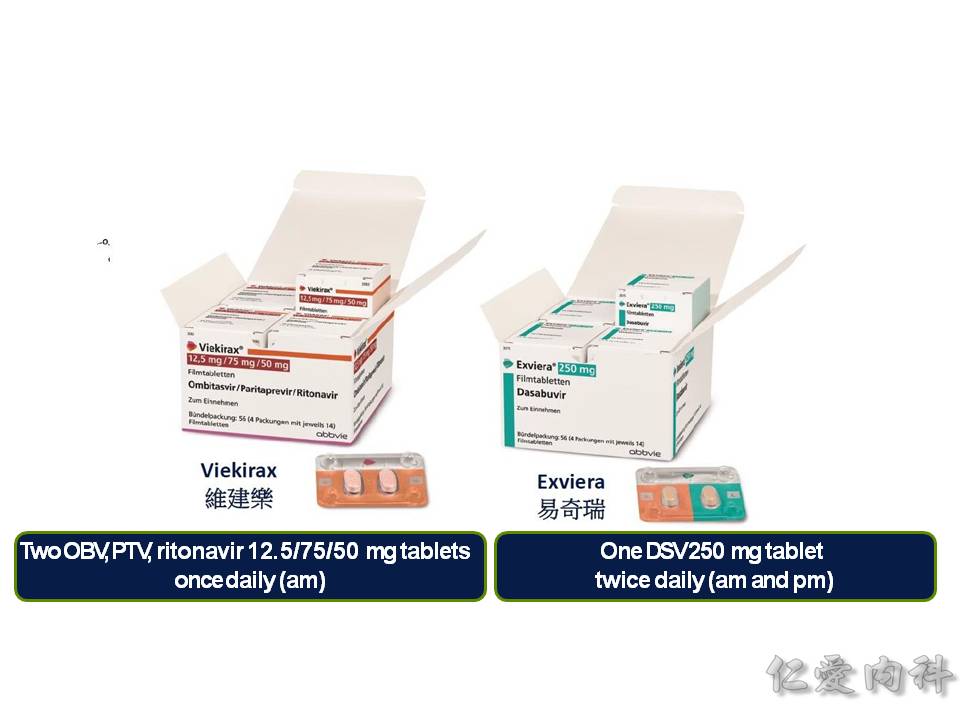
- Viekira Pak (ombitasvir/paritaprevir/ritonavir + dasabuvir) = PROD regimen,也是一個複方藥物,合併了兩種藥物: ombitasvir/paritaprevir/ritonavir;dasabuvir,這個藥物要很注意的是它會造成肝臟的負擔,所以有發生過肝臟衰竭的紀錄。所以若是 genotype 1b 加上輕度肝硬化的病人 (Child-Pugh A) : 要合併 Ribavirin 藥物使用12週;而 genotype 1b 無肝硬化的病人,單獨使用 12 週。
- 最後一個藥物 Elbasvir/grazoprevir 也是一個複方藥物,也都是 DAA,可以使用在 genotype 1, 4 上面。

Viekira Pak (ombitasvir/paritaprevir/ritonavir + dasabuvir),是一個複方藥物,這個藥物要很注意它會造成肝臟的負擔,所以有發生過肝臟衰竭的紀錄,目前只有肝硬化 Child-Pugh A 病人才可以使用。
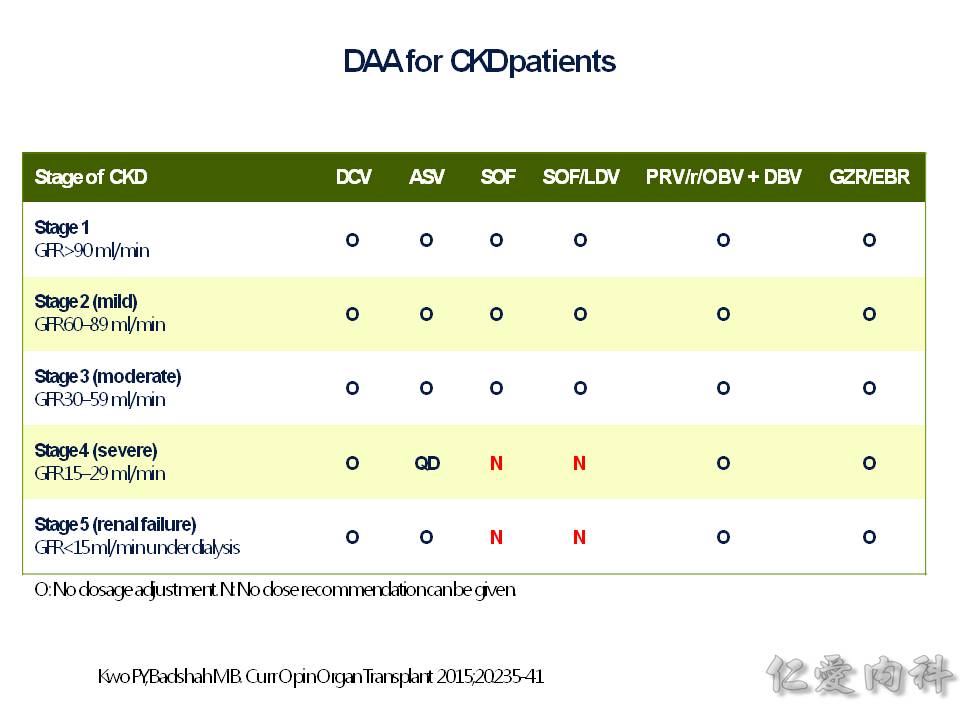
若是病患腎臟功能不好,在 eGFR < 30,就不能使用 sofosbuvir 這個藥物。
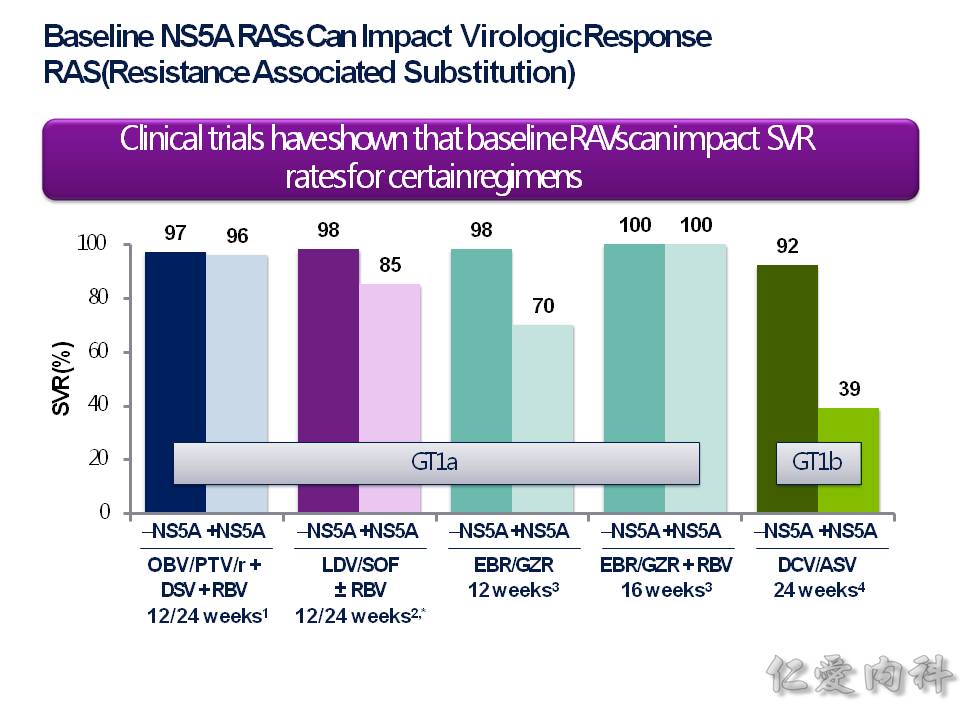
因為台灣基因型 genotype 1b 很多,當我們要開始使用 Daklinza (daclatasvir) + Sunvepra (asunaprevir) 這個複方藥物治療 HCV-1b 之前,要先驗在 NS5A 這個基因段落有沒有突變,就是驗RAS (resistance associated substitution) 有無,有 NS5A 突變的話,會讓藥物 Daklinza(daclatasvir) 效果變很差,進而治療失敗!
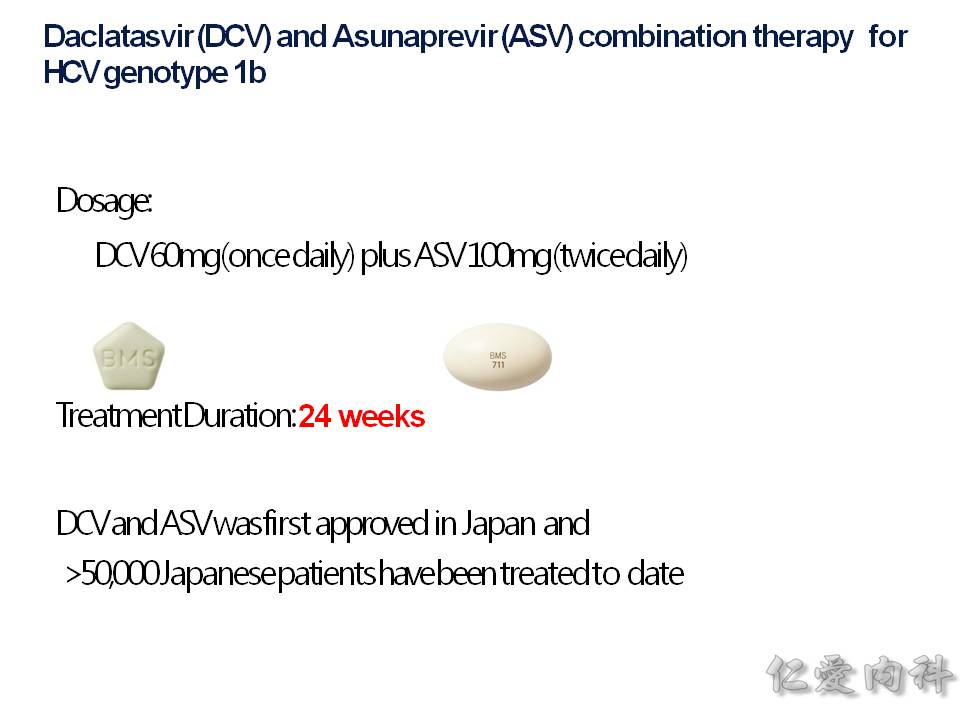

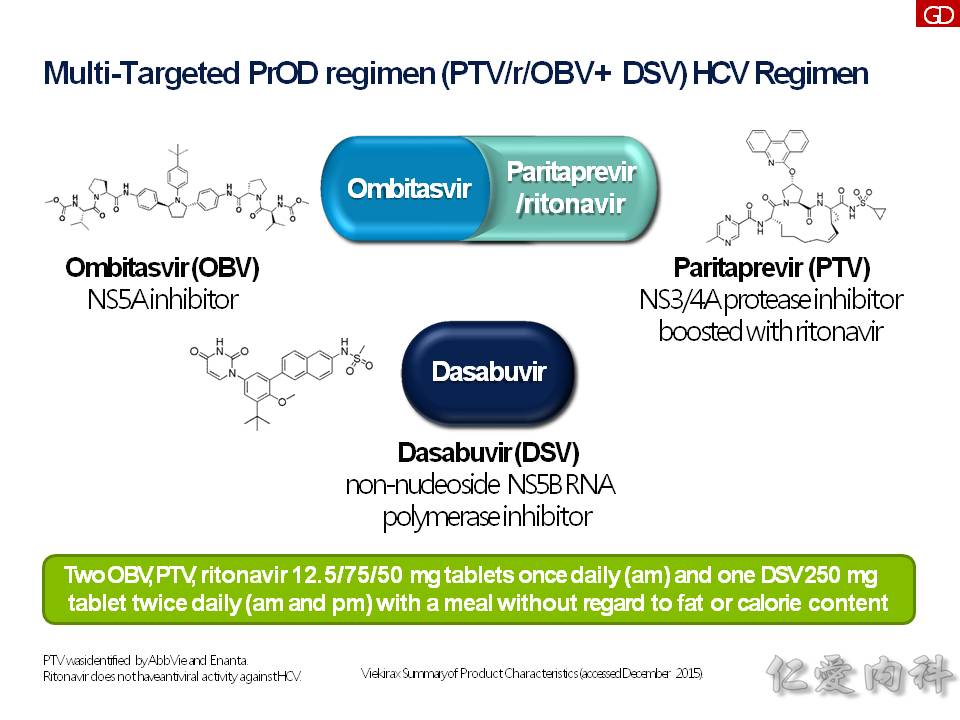

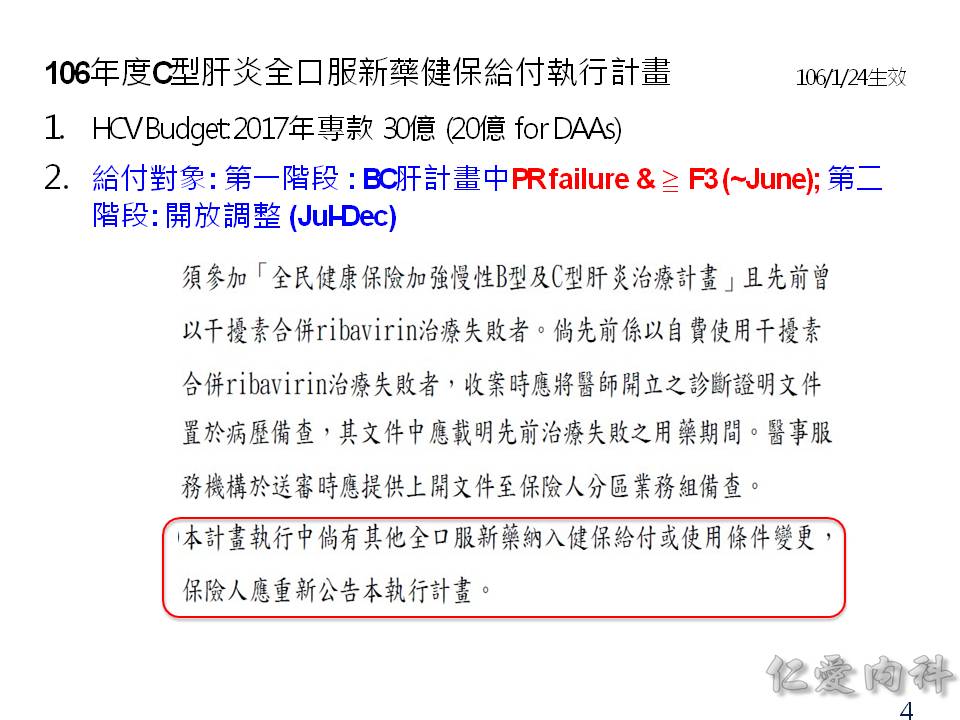

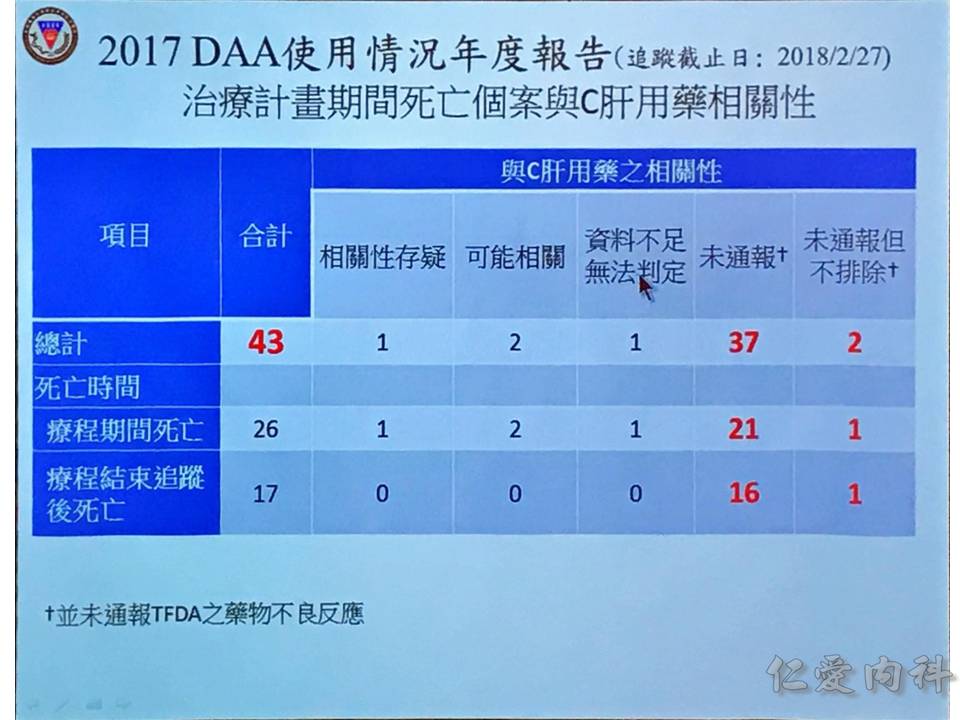
因為國際上大家一致的目標是要根除 C 型肝炎,台灣政府於 2017 年撥款 20 億元在 DAA 藥物上,使用在 Metavir F3, F4 的病人身上,或者是肝硬化 + 脾腫大、肝硬化 + 胃或食道靜脈曲張的病人。
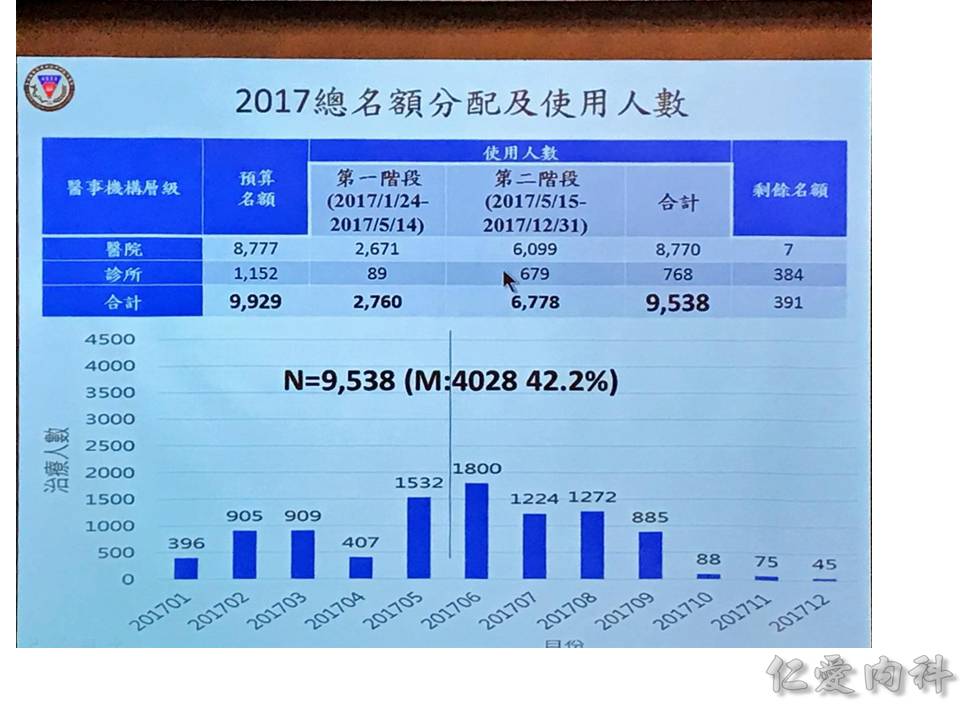

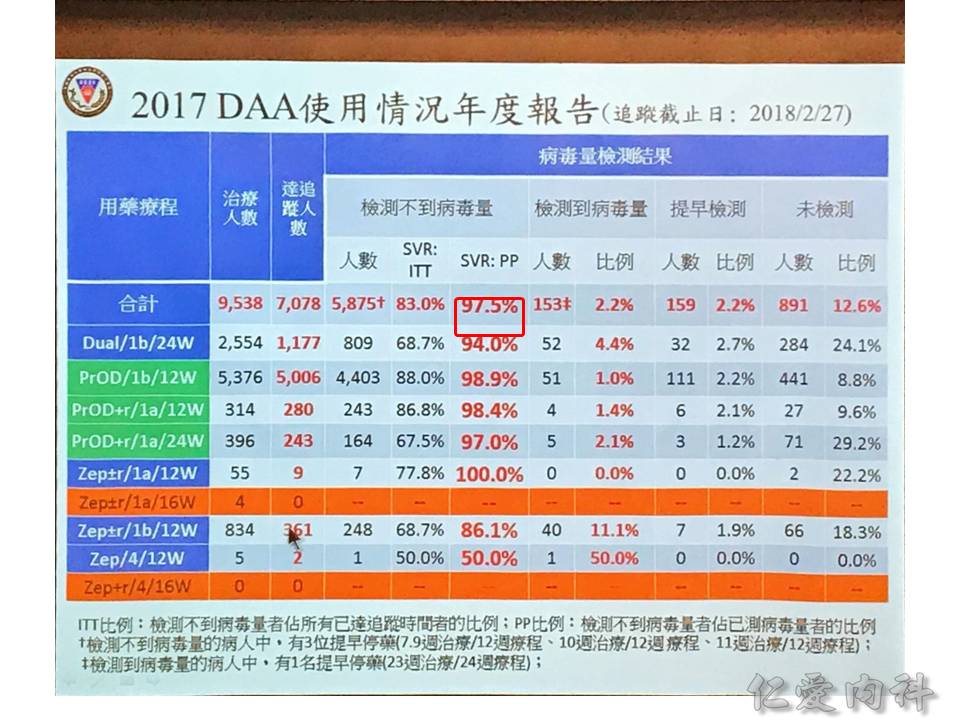
成效的部分,統計到 2018/02/07 為止,有 97.5% 的 sustained viralogic response: 在治療完 12 週再抽血都沒有看到 C 肝病毒。
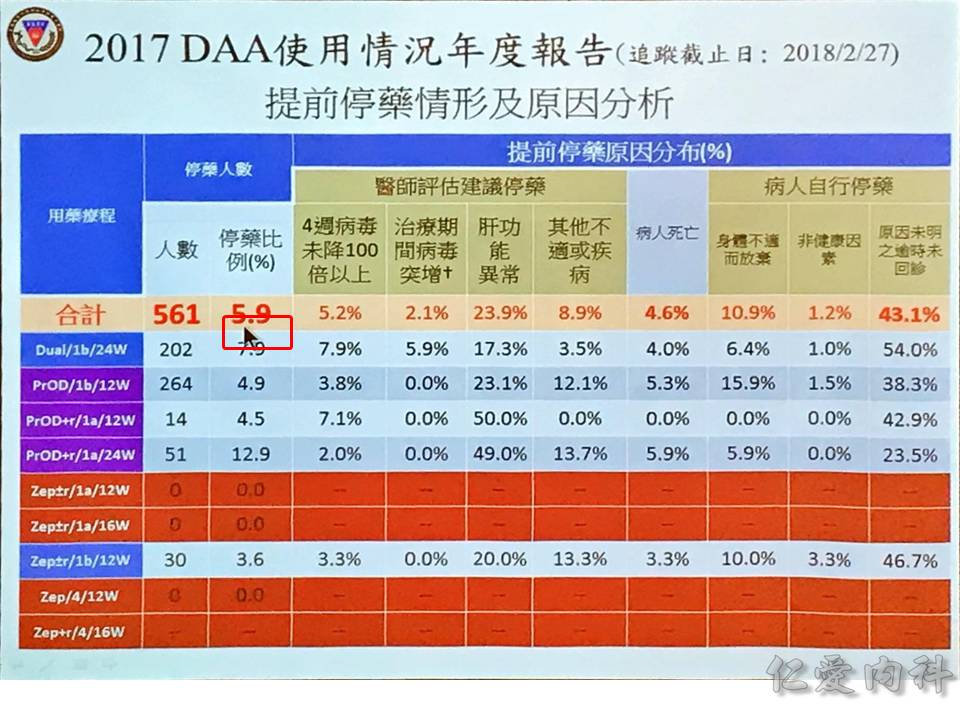
停藥的情況,醫學上很大部分是因為肝功能異常,另外一部分是因為治療失敗。